04臨床試験Clinical Trials
| 試験デザイン | プラセボ対照無作為化二重盲検比較試験 |
|---|---|
| 対象 | 下記所見をすべて満たす慢性腎臓病の猫 血清クレアチニン≧1.6mg/dL、尿比重<1.035、T4 0.9-3.8μg/Lの猫 |
| 有効性解析対象症例 | 63例(ラプロス®群 31例、プラセボ群 32例) |
| 安全性解析対象症例 | 74例(ラプロス®群 36例、プラセボ群 38例) |
| 投与方法 | ラプロス®またはプラセボを朝晩の食後に1錠ずつ経口投与した |
| 試験期間 | 180日間 |
| 有効性評価項目 |
血清クレアチニン、BUN、体重、臨床症状スコア(食欲、活動性、脱水)※、飼い主によるQOL評価、担当獣医師による全般的改善度など ※臨床症状スコア
|
| 安全性評価項目 | 一般状態、血液検査、有害事象など |
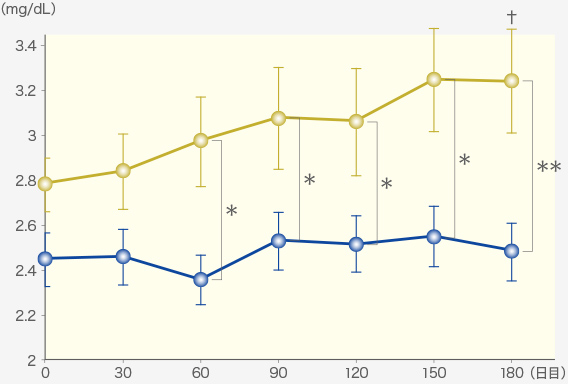
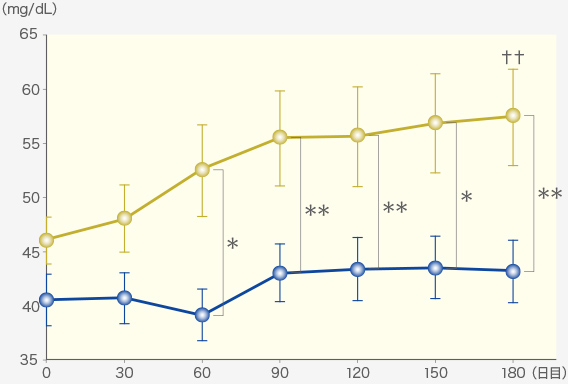
ラプロス®の投与により血清クレアチニン値、
BUNの上昇が抑制されました。
血清クレアチニン
BUN
国内申請資料
- ラプロス®群
- プラセボ群
群内比較(pre vs post):Repeated measures ANOVA (†:P<0.01, ††:P<0.001)
群間比較(ラプロス®群 vs プラセボ群):Factorial ANOVA (*:P<0.05, **:P<0.01)
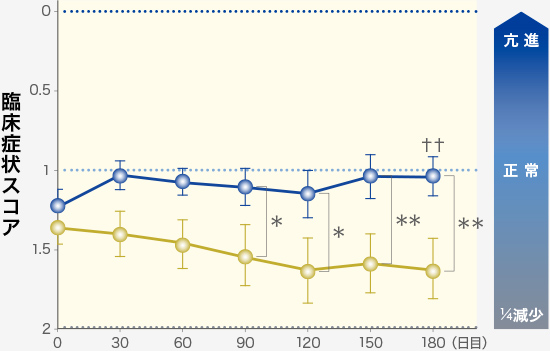
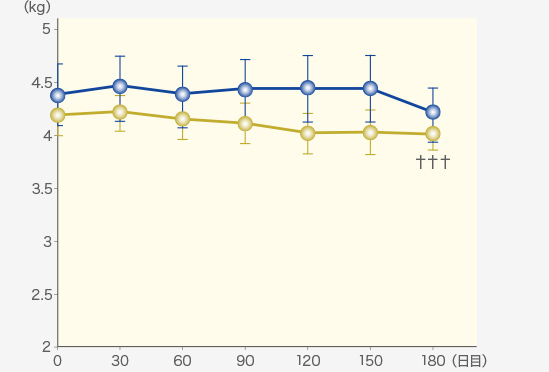
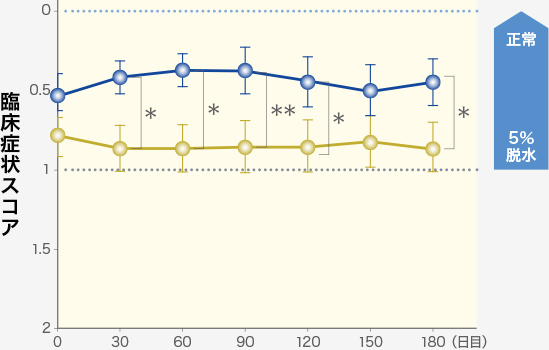
ラプロス®の投与により食欲不振が改善され、
体重減少が抑制されました。
また、活動性の低下も抑制されました。
体重および臨床症状の推移
国内申請資料
- ラプロス®群
- プラセボ群
群内比較(pre vs post):Repeated measures ANOVA (†:P<0.01, ††:P<0.001)
群間比較(ラプロス®群 vs プラセボ群):Factorial ANOVA (*:P<0.05, **:P<0.01)
食欲
体重
活動性
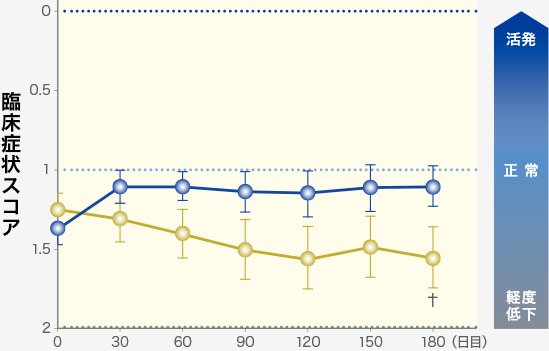
脱水
ラプロス®の安全性評価
臨床試験において薬剤投与と因果関係がある、または不明と判定された有害事象
主な有害事象
| 因果関係 | 試験群 | 内容 | 件数 |
|---|---|---|---|
| あり | プラセボ群 | 嘔吐(軽微) | 1件 |
| 不明 | ラプロス®群 | 食欲減少・体重減少(中等度) | 1件 |
| プラセボ群 | 発作(中等度) | 1件 | |
| 血混じりの嘔吐(軽微) | 1件 | ||
| 肝酵素上昇(中等度) | 1件 |
- 対象動物安全性試験
- 健常猫における臨床用量の3倍量までの安全性試験(182日間)では一般状態、体重、摂餌量、摂水量、尿検査、血液学的検査、血液生化学的検査、血液凝固検査、眼科学的検査、心電図検査、剖検、および組織学的検査等の病理学的検査において、ラプロス®投与に起因すると考えられる変化は認められませんでした。国内申請資料

